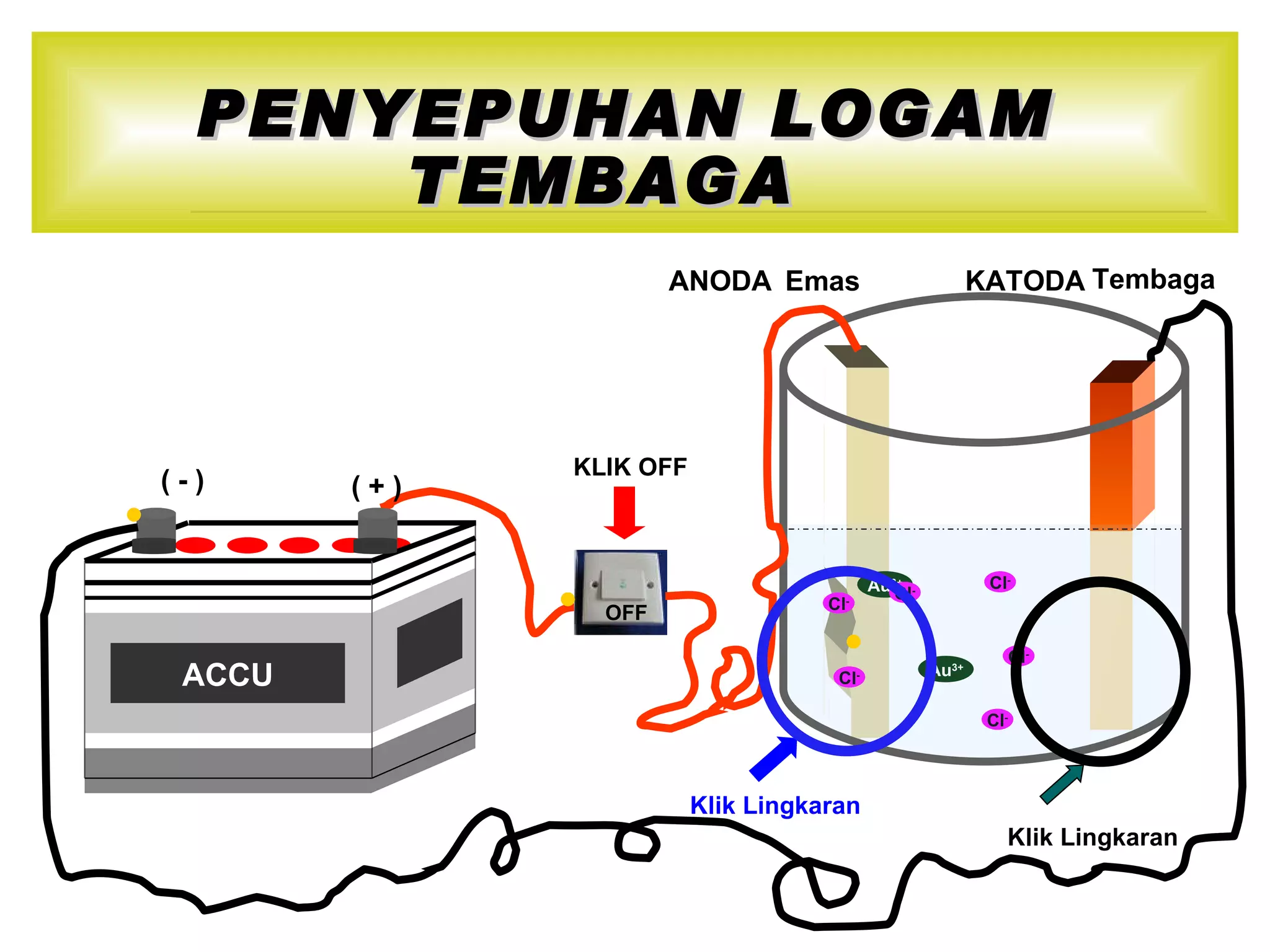
Reaksi redoks dan aplikasinya. Reaksi redoks melibatkan transfer elektron dan perubahan bilangan oksidasi. Dokumen ini menjelaskan konsep reaksi redoks termasuk definisi, contoh, aturan bilangan oksidasi, dan metode penyetaraan persamaan reaksi redoks.